國家衛生研究院細胞與系統醫學研究所副所長李華容及台大醫院郭文宏醫師合作,發現癌細胞藉由調控Ago2 K212去乙醯化產生腫瘤特有的Ago2/CAV1新穎交互作用,進而促使腫瘤透過外泌體釋放特定miRNA。並分析乳癌患者檢體中發現可反映乳癌轉移之外泌體疾病生物標誌。此發現證實外泌體核酸可作為疾病生物標的,對於未來癌轉移偵測及治療將有相當大的助益。此研究成果已於2024年發表在國際知名學術期刊《EMBO reports》[1]。
幾乎所有細胞都能釋放外泌體(exosome),其攜帶來源細胞中特定的蛋白質、核酸及代謝物,在細胞與細胞之間的相互溝通中發揮重要作用。外泌體存在於不同類型的生物液體中並且和許多疾病的機轉有關,包含癌症、神經退化疾病和心血管疾病等。這些和疾病發展有關連的外泌體可用非侵入性的方式偵測,開發做為檢測、預後和治療疾病的非侵入性生物標誌物具有潛力。

圖1. (從左至右) 細研所所長郭呈欽、台大醫院醫師郭文宏、國衛院副所長李華容、副院長陳為堅;圖片提供:國衛院
Ago2在許多腫瘤中有過度表現的現象,是miRNA在抑制基因表現中的核心角色。Cav1是細胞膜上的重要結構蛋白,它的活性經由與許多信號蛋白直接互動來調節,並在信號傳導中扮演重要角色。研究團隊在癌細胞中發現一種新穎的Ago2/Cav1相互作用,調控Ago2在癌細胞中的分佈和功能,且在正常細胞中沒有此種作用進行。

圖2. 細胞及系統醫學研究所副所長李華容展示含有乳癌特定生物標記之外泌體模型;圖片提供:國衛院
研究顯示在癌細胞中,Cav1會將Ago2吸引至細胞膜上,Ago2/Cav1的交互作用抑制了癌細胞中miRNA抑制基因表現的功能,進而讓癌細胞miRNA藉由外泌體釋放進入血液循環。Ago2/Cav1的交互作用會隨著癌症發展的進程增加,進而促進腫瘤的侵襲行為,例如癌轉移。在細胞實驗及動物實驗中證實藉由蛋白多肽及去乙醯化酶抑制劑可抑制癌細胞中Ago2/Cav1的交互作用,進而抑制了癌轉移。在乳癌轉移患者的臨床血液檢體中,研究團隊偵測到藉由Ago2/Cav1交互作用釋放的特定外泌體miRNA含量明顯較未轉移患者的血液中高。
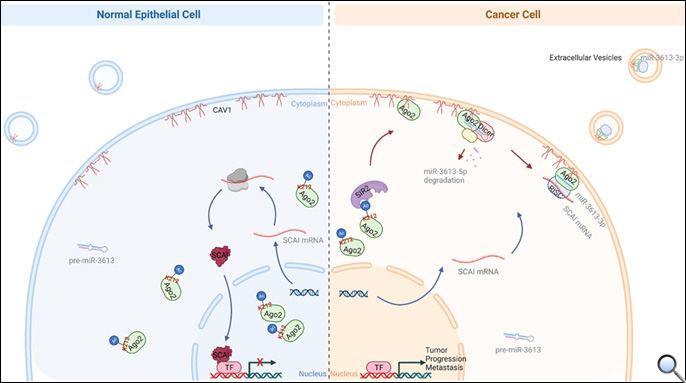
圖3. 癌細胞特有Ago2/CAV1交互作用控制腫瘤轉移及外泌體釋放示意圖;圖片提供:國衛院
國衛院過去十幾年來接續研究外泌體在細胞組織再生及癌症中扮演的角色,例如發現幹細胞藉由外泌體維持及傳遞其特性,開發誘發癌細胞外泌體釋放的技術,以及開發了「誘導型外泌體技術」以治療腦損傷,並攜手產業持續研究應用於腦中風後治療。此次研究發現外泌體具有開發潛力,作為抑制癌轉移的藥物標的及用於檢測癌轉移的外泌體生物標誌,對於未來許多疾病的偵測及治療將有相當大的助益。
備註:
- Ago2/CAV1 interaction potentiates metastasis via controlling Ago2 localization and miRNA action, Meng-Chieh Lin, Wen-Hung Kuo, Shih-Yin Chen, Jing-Ya Hsu, Li-Yu Lu, Chen-Chi Wang, Yi-Ju Chen, Jia-Shiuan Tsai, and Hua-Jung Li, EMBO Reports, 22 April 2024
| 作者: |
李淑蓮 |
| 現任: |
北美智權報總編輯 |
| 學歷: |
文化大學新聞研究所 |
| 經歷: |
北美智權報主編
半導體科技雜誌(SST-Taiwan)總編輯
CompuTrade International總編輯
日本電波新聞 (Dempa Shinbun) 駐海外記者
日經亞洲電子雜誌 (台灣版) 編輯 |
|
|
|
| Facebook |
|
在北美智權報粉絲團上追踪我們 |
     |
|
|
|
|
|
|
|

