除了專利佈局之外,營業秘密保護亦是生物藥品創新保護策略的重要一環。對於AbbVie公司旗下位居全球銷售排行第一名的Humira的生物藥品,不僅以高密度專利保護屏障,AbbVie公司更積極對於嘗試進入全球市場的藥廠祭出專利訴訟與營業秘密訴訟。2020年當Alvotech宣稱其向FDA提出生物相似藥(Biosimilars)的上市申請,其後不久,在2021年3月19日AbbVie公司,於美國伊利諾伊州北區地方法院向Albotech提起營業秘密侵害訴訟,指控Alvotech侵害其營業秘密。本文將分析營業秘密與生物藥品保護關聯性、以及近期生物藥品營業秘密訴訟概況。

圖片來源 : shutterstock、達志影像
生物藥品的製造與營業秘密保護
藥品研發上市期間,需進行動物藥毒理試驗、臨床試驗等驗證,以提供藥品之安全、品質與療效證據,其製造程序,將依各期試驗對藥品數量之需求,由小批量逐步放大。為了提高品質與產率,製造過程常會進行優化,例如:改進純化步驟以減少不純物、更新製造設備或程序、甚至更換細胞株等都是研發過程常見的措施。生物藥品,如基因治療產品、蛋白質藥品、抗體、生物相似性藥品、癌症疫苗、如何確定分子內每一部分的特性具有相當程度的一致性為評估產品品質重要關鍵,因此,各國衛生主管機關均將生物藥品的化學製造管制部分列為重要審查考量(相關審查規範請參閱《北美智權報》289期:我國生物藥品監管與專利策略—由Humira案例談起),生物藥品的製程與管制流程概述如圖1。
圖1:生物藥品的製程與管制流程概述
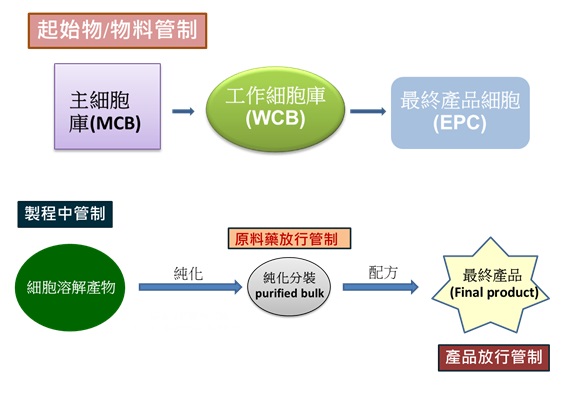
資料來源: 財團法人醫藥品查驗中心
為符合生物藥品的製程管制之品質規範、降低成本、加速藥品上市,諸多生物技術應用於製程改善的創新研發為藥廠所重視,一般來說先進的製造技術常有下列幾項特性:
- 整合新技術方法
- 以新的或創新的方式使用既定技術,或
- 在沒有明確的最佳實踐或經驗的新領域中應用生產方法。
製造技術的創新將有助於完善疫苗、醫藥品供應和強化醫療應變能力,以更快因應新出現的疾病威脅和其他突發公共衛生事件,例如流感疫苗或特殊生物藥品之供應,可通過創建小型製造基地的分佈式網絡,縮短供應鏈,並加速生物藥品製造。各國衛生主管部門也鼓勵藥廠研發創新的藥品製程,以更快速處理緊急公共衛生事件(如COVID-19)或天災(如颶風、地震)所造成之藥品短缺。另亦可藉由新穎性製程的成本效率,加快孤兒疾病療法與重大疾病等生物藥品的開發,加快新興療法(細胞或基因治療)與個人化精準醫療的應用。
先進的製造技術也應用於確保生物藥品製造過程的品質,以減少可能的汙染、改善儲存條件讓生物藥品更安定,降低生物藥品裂解產生不純物的可能性。連續製造技術(Continuous Manufacturing Processes)是現代科技領域的結合,用以精進傳統的藥品逐步製造過程,建立即時監控和強化品質控制的單一系統,採取一致化標準製程,因此,連續製造技術為更有效率、更可靠的先進製造技術,只要原料不間斷供應即可持續生產製造,視市場供應情況控制生產的產品數量以滿足需求(傳統批量生產與連續生產的比較如圖2),而且生產和純化製程的先進技術可以縮短處理時間,減少人工干預,並通過使用較小的生物反應器降低設施規模及所需的場域空間。美國食品藥物管理局(USFDA)正討論創新的生物藥品製造技術規範,針對藥廠採用連續製造的技術,整合生物藥品生產的各項步驟,應如何符合藥品審查的要求。
圖2:批量生產與連續生產的比較
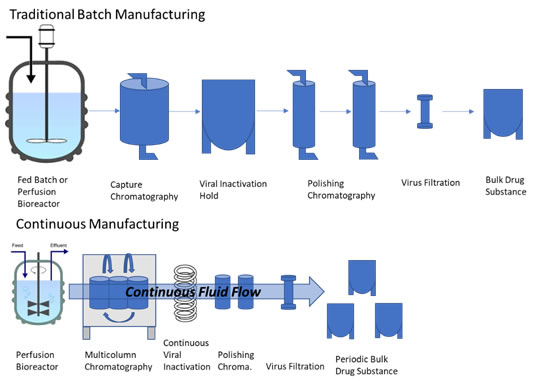
資料來源:https://www.fda.gov/drugs/regulatory-science-action/impact-continuous-manufacturing-processes-viral-safety-therapeutic-proteins
連續製造對於生物藥品(如治療性抗體、疫苗)來說仍然是一個新挑戰,尤其需要更多研究探討如何確保生物藥品不會受到病毒或其他污染。這些高效、統合諸多科學技術的連續系統,需要的製造空間也比傳統製藥廠小,未來極可能由小分子化學藥開始應用,並拓展到大分子生物藥品的製程。降低成本提高效率吸引藥廠投入創新製造技術之研發,新穎性製程也為藥廠提供新的專利佈局契機,至於製造技術的創新應以專利進行保護,或以營業秘密密規劃,對於製造技術的創新最有保障,實為非常值得深入探討的議題。
生物性藥品核准與BPCIA
多數生物藥品與生物相似性藥品的訴訟,以專利侵權訴訟為主。也因為生物藥品多由為數眾多的專利組合所保護,因而造成生物相似性藥品進入市場的障礙,也導致生物藥品價格高居不下。為加速生物相似性藥品進入市場,並降低生物藥品價格,美國國會於2009年通過《生物製品價格競爭和創新法》(Biologics Price Competition and Innovation Act, BPCIA),為生物相似性藥申請與審查,建置法制架構。在BPCIA的架構下,第一個取得生物藥品的藥商將與後來申請生物相似藥品的藥商,雙方於生物相似藥品有機會於生物相似性藥品上市之前,解決專利爭議[1]。
以Humira為例,該藥物被核准用於多種炎症,包括類風濕性關節炎和克隆氏症。Humira活性成分阿達木單抗(Adalimumab)是一種針對人類腫瘤壞死因子(tumor necrosis factor-alpha)的全人源抗體。由於每年上看美金上百億的全球市場規模,因此,即使AbbVie已為Humira建構了史上最嚴密的專利保護屏蔽,在主要專利即將到期之際,成為許多生物藥品製造商的突破專利保護的重要目標。在美國BPCIA架構下,生物相似性藥品專利訴訟的啟動,是因為生物相似性藥品廠商向USFDA提交的簡化生物藥品許可申請(aBLA),而使第一個取得生物藥品上市許可藥商,基於BPCIA的規定啟動了相關專利爭議解決程序。Alvotech USA於2020年11月19日向USFDA提交了Adalimumab的生物相似性藥品上市申請,因而啟動了Alvotech和Abbvie之間的“patent dance” 程序,促使Abbvie與Alvotech交換專利與營業秘密資料[2]。
備受討論的Humira專利資產組合由100多項專利組成,涵蓋治療、管理、配方、製造工藝和相關設備等各個方面,這些專利佈局有效延長了Humira的生命週期。例如:美國發明專利US9085619B2(其專利名稱為「抗TNF抗體製劑」配方),將於2028年11月28日屆滿[3]。和美國發明專利US8420081B2(名稱為「抗體製劑及其製造方法」),本發明提供了一種包含水和蛋白的水製劑及其製備方法;本發明的水製劑可以是高蛋白製劑和/或可以具有由低水準的離子型賦形劑產生的低水準的電導率,專利約於2030年到期。又名稱為「用於治療 TNF-α相關疾病的多變量劑量方案」的美國發明專利US8961973B2,則描述了一種用於治療 TNF-α相關疾病,包括克隆恩等疾病的多變量劑量方法,專利將在2025年到期[4]。
2021年4月27日,AbbVie根據BPCIA規定對於Alvotech提出損害賠償訴訟,並指控Alotech提出生物相似藥申請侵犯AbbVie專利[5],於Patent dance程序中,要求被告提供生產方法、治療方法、劑量方案以及涉及的相關配方。AbbVie依據BPCIA的規定,於最初的專利舞蹈(patent dance)程序揭露涉及Humira生物藥品相關之62個專利,但最終AbbVie只對其中四個專利提起訴訟,包括美國專利號8,420,081、美國專利號8,926,975、以及美國專利號8,961,973、和美國專利號 9,085,619等四個專利。於訴狀中,Alotech指出,AbbVie在伊利諾州北區起訴控告Alotech並不合法,因為USA Alotech與Alotech為二間公司,前者為母公司,而後者為子公司。向美國FDA遞交生物相似藥品上市申請的為母公司,因此AbbVie應該向Alotech總公司提告,而非向美國子公司提訴。緊接著,2021年5月11日,Alotech則向維吉尼亞州東區地方法院提出對AbbVie的不侵權的確認訴訟[6],。
AbbVie與Alotech間營業秘密訴訟
在Humira案例中,除了專利訴訟外,觀察法院的案件,生物藥品藥廠對於進入市場的生物相似藥品也提出營業秘密侵害之訴訟。因此,營業秘密保護策略,對於生物藥品智慧財產權保護,也發揮重要的作用。以AbbVie與Alvotech二間公司,對於生物藥品之製造所衍生的創新保護爭議,除了專利爭議以外,營業秘密爭議亦是觀察重點。2021年3月19日AbbVie在美國伊利諾伊州北區地方法院提起營業秘密侵害訴訟[7],指控Alvotech侵害其營業秘密,後續發展值得關注。
AbbVie在上述營業秘密訴訟中,AbbVie特別指出,生物藥物製造是一個複雜而敏感的過程,需要花費大量時間和大量專業知識,以對於量產程序上進行開發和微調。AbbVie 已經花費大量資源來開發Humira大量、連續的生產流程。為了保護這些生產訊息,AbbVie僅在必要的情況下與員工分享這些資訊,包括訓練員工如何進行商業化、大規模、高質量的製造流程。這些機密和具有商業價值訊息與 AbbVie阿達木單抗配方、生產方法相關的專利內容不同且性質不同。 Alvotech公司如其他Humira的相似性藥品的製造廠商一樣,想要進入美國市場。但AbbVie,指控Alvotech並為採取正當方法,而妄想利用捷徑,透過AbbVie之前員工以竊取Humira量產之技術。
2020年11月,Alvotech公司,宣布美國FDA和歐洲藥品管理局,已受理Alotech公司提出的AVT02的生物製劑許可申請。隨後,2021年AbbVie指控Alotech公司侵害Humira相關專利,以及侵害營業秘密訴訟。
有關營業秘密訴訟,起因於今年三月,原告AbbVie公司於訴訟中指控被告Alvotech公司以不正當方法取得生物相似性藥品的製造工法,原告認為被告對於生產工法未投入相當必要的時間和資源,因此不足以獨立開發出生物藥品相對應的工法。原告認為被告Alvotech公司所使用的不法手段,包括透過原告前員工取得AbbVie與Humira的量產工藝相關的機密和專有商業秘密,以便開發和製造生物藥品。AbbVie指出,Rongzan Ho任職於AbbVie期間為位居高階製造團隊的負責人,於2018年2月離開公司後,受僱於Alvotech公司,其主要工作就是為Alovotech開發阿達木單抗的生物相似藥,即AVT02。Rongzan Ho曾有3次嘗試將商業機密轉移到個人的私人電子郵件帳戶,但被電子安全監控系統阻止了兩次。而於第三次嘗試過程中,Rongzan Ho設法欺騙IT安全系統,以解除對系統防護對於傳輸資訊的限制。AbbVie公司表示Rongzan Ho的離職表格中,記載他將前往Alvotech公司,以學習生物反應器和其他新技術,然而實際上,Rongzan Ho卻將有爭議的生產資料帶到Alvotech公司,以便開發AVT02的製造方法,以與AbbVie公司同時競爭全球阿達木單抗製劑(adalimumab)的市場。AbbVie更指稱,2020年5月,Alvotech僱用了另外2名AbbVie員工,以取得對於阿達木單抗的製造過程的相關資訊。
對於AbbVie公司一連串的指控,Alvotech公司強烈發表聲明,並指出AbbVie所提出的營業秘密訴訟,是一系列延遲新興競爭對手策略中一環,以避免為患者提供Humira高濃度藥物的低成本替代方案產品。因為,AbbVie從前員工涉嫌盜竊商業秘密之日起3年多才提起訴訟,並且也沒有將前員工列為被告。因此,Alvotech質疑案件背後的動機。
備註:
-
Alejandro Menchaca ,The Inner Workings of the BPCIA Patent Dance, July 24, 2021 https://www.centerforbiosimilars.com/view/the-inner-workings-of-the-bpcia-patent-dance
-
AbbVie filed a second complaint against Alvotech , 2021/6/18 https://www.maxval.com/blog/abbvie-files-a-second-suit-against-alvotech/
-
Anti-TNF antibody formulations, https://patents.google.com/patent/US9085619B2/en
-
Multiple-variable dose regimen for treating TNFα-related disorders, https://patents.google.com/patent/US8961973B2/en
-
AbbVie, Inc. et al. v. Alvotech hf., 1:21-cv-02899, https://litigationtools.maxval-ip.com/UnifiedPatentViewDocument/home/index?caseid=499856
-
Alvotech USA Inc. et al. v. AbbVie, Inc.1:21-cv-00589 -
-
http://freepdfhosting.com/708ec81d5d.pdf
【本文僅反映專家作者意見,不代表本報立場。】
| 作者: |
葉雲卿 |
| 現任: |
世新大學 智慧財產暨傳播科技法律研究所 教授 |
| 學歷: |
美國舊金山金門大學 法律博士(SJD)
美國華盛頓大學 法律碩士(LLM)
國立政治大學 法律碩士
國立台灣大學環境工程所 工程碩士 |
| 經歷: |
台灣科技大學專利所 助理教授
美國舊金山 Suzan See Law Office法務
美國矽谷 Vivian Lu Law Office法務
台灣建業律師聯合事務所律師
台灣環宇律師事務所律師 |
| 產學合作計畫: |
美國訴訟管理產學合作計畫 |
| 代表著作: |
營業秘密刑事責任
中小企業智慧財產權管理制度建置
專利意見書在訴訟上之運用 |
| 證照: |
律師、台灣專利代理人、環境工程技師、仲裁人、ISO14000管理師 |
|
|
| 作者: |
張連成 |
| 現任: |
中央研究院 智財技轉處 科長
陽明交通大學藥物科學院藥學系 兼任助理教授 |
| 學歷: |
陽明大學生物藥學所博士 |
| 經歷: |
衛生福利部食品藥物管理署 技正、副研究員、科長 |
|
|
|
| Facebook |
|
在北美智權報粉絲團上追踪我們 |
     |
|
|
|
|
|
|
|

