| 很明顯的,全球生技藥品的相關專利申請人大多為歐美大藥廠,在中國大陸市場也不例外,但是歐美大藥廠在中國大陸的發展與獲利似乎並不如預期,例如葛蘭素史克 (GSK) 2013年在中國大陸被控行賄而造成獲利衰退、阿特維斯 (Actavis) 2014年初表示因招標、銷售等問題而欲退出中國大陸市場等。 因此,王美花建議台灣廠商可以思考如何利用「兩岸醫藥衛生合作協議」,例如可依「兩岸藥品研發合作專案試辦計畫」向衛生福利部食品藥物管理署(TFDA)提出申請,以減少重複試驗為目標,並透過試點及專案方式,推動兩岸臨床試驗及醫藥品研發合作,使藥品儘早進入中國大陸市場。 |
繼前期文章《智財局長:生技醫藥缺乏專利保護 一顆藥兩百僅剩兩塊》後,本期繼續報告生技產業的專利申請趨勢及注意事項。智慧局局長王美花指出,2008年受全球經濟崩盤影響,2009年外國人來台申請案件明顯下降,至2010年起緩慢恢復提升;此外,台灣本國人申請案數量從2011及2012年起緩慢增加,顯示台灣生技產業競爭力在這幾年努力已有成果,可是2013年整體生技相關申請案量又明顯下降,故應密切注意後續發展。
圖 1. 2007 ~ 2013 年生技發明專利申請量
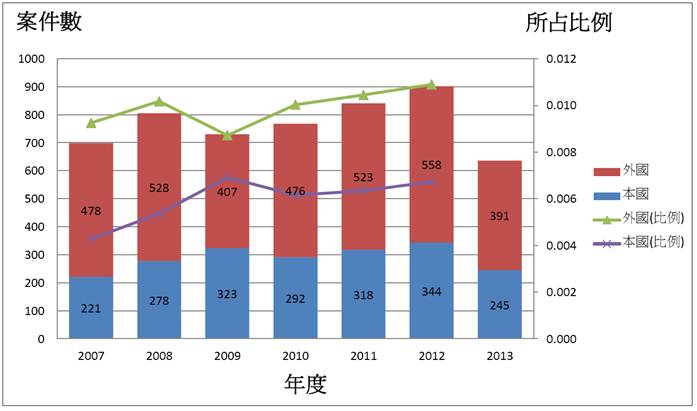
資料來源:智管會生技經營戰略研討會,智慧局局長王美花簡報 2014/04/18
附註:(1) 生技產業IPC分類(依據OECD定義,包等括動植物技術、單純核酸、蛋白質發明以及生技醫藥等):A01H1/00、A01H4/00、A61K38/00、A61K39/00、A61K48/00、C02F3/34、C07G11/00、C07G13/00、C07G15/00、C07K4/00、C07K14/00、C07K16/00、C07K17/00、C07K19/00、C12M、C12N、C12P、C12Q、C12S、G01N27/327、G01N33/53*、G01N33/54*、G01N33/55*、G01N33/57*、 G01N33/68、 G01N33/74、G01N33/76、G01N33/78、G01N33/88、G01N33/92。(2) 比例為占當年度發明專利申請案總數之比例,即(外國或本國人生技發明申請案件數) 除以(發明專利申請案該年總件數)。
圖2. 2007~2013年醫療發明專利申請量
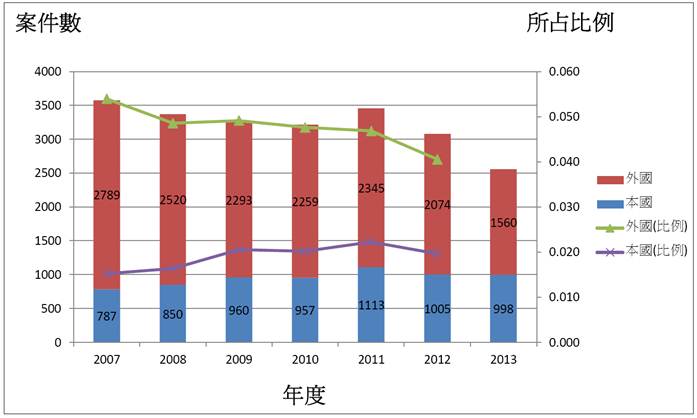
資料來源:智管會生技經營戰略研討會,智慧局局長王美花簡報 2014/04/18
附註:(1) 醫療產業IPC分類(主要為醫藥配製品):A61B、A61C、A61F、A61G、A61H、A61J、A61K、A61L、A61M、A61N、A61P、A61Q。 (2) 比例為占當年度發明專利申請案總數之比例,即(外國或本國人醫藥發明申請案件數) 除以 (發明專利申請案該年總件數)。
上圖2是我國2007~2013年醫療發明專利申請量,王美花指出,整體醫藥品 (其中大多為小分子藥物) 申請案數量呈現下降趨勢,尤其是2009年開始,外國人來台申請案件比例明顯下降,顯示外商專利權人對我國醫療產業市場缺乏專利佈局動機,另有一種說法是由於健保一直調降藥價,導致有些外商因為利潤變薄而幹脆放棄台灣市場。另一方面,本國人申請案數量近幾年有增加趨勢,可見我國醫療廠商在這幾年持續努力的成果。
王美花指出,目前我國生技產業發明專利申請量最多之IPC分類為A61K 39/395 (抗體),與2013年全球10大暢銷藥中有5個即是單株抗體藥Humira、Remicade、Rituxan (以上主要治療類風濕性關節炎)、Avastin (大腸癌) 及Herceptin (乳癌) 的趨勢相符,單株抗體藥或其生物相似藥 (biosimilars)應是未來開發主流,可是技術與投資門檻偏高,不過國內廠商 (如台灣醣聯、聯亞生技、中裕新藥等) 亦有單株抗體藥物進入國內外臨床試驗階段或進行生物相似藥品之開發。
很明顯的,全球生技藥品的相關專利申請人大多為歐美大藥廠,在中國大陸市場也不例外,但是歐美大藥廠在中國大陸的發展與獲利似乎並不如預期,例如葛蘭素史克 (GSK) 2013年在中國大陸被控行賄而造成獲利衰退、阿特維斯 (Actavis) 2014年初表示因招標、銷售等問題而欲退出中國大陸市場等。
因此,王美花建議台灣廠商可以思考如何利用「兩岸醫藥衛生合作協議」,例如可依「兩岸藥品研發合作專案試辦計畫」向衛生福利部食品藥物管理署(TFDA)提出申請,以減少重複試驗為目標,並透過試點及專案方式,推動兩岸臨床試驗及醫藥品研發合作,使藥品儘早進入中國大陸市場。
圖3. 2007~2012年全球主要區域生技醫療產業發明專利公開概況
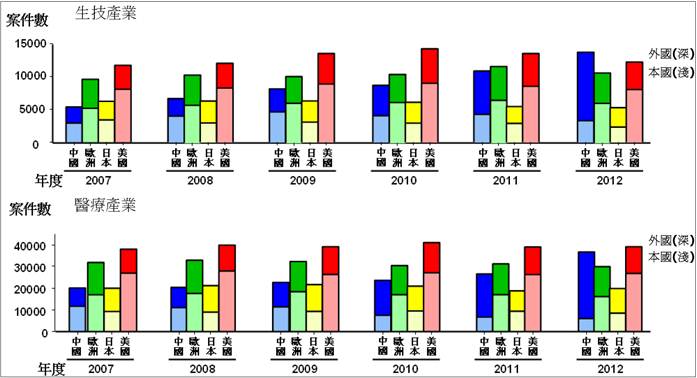
資料來源:智管會生技經營戰略研討會,智慧局局長王美花簡報 2014/04/18
附註:(1) 數據來源為WIPO IP Statistics Data Center ,統計數據係根據申請案公開日,相較於國際申請日約有6個月的延遲。 (2)美國與歐洲之申請人主要為本國籍,日本之申請人雖為本國與外國約各半,惟其申請案總量較低,中國大陸之申請案近年來大幅攀升,惟主要是外國申請案大幅度的增加,本國申請案甚至有約略下降之趨勢。
從上圖3的趨勢看起來,中國的本國申請案萎縮相當嚴重,究竟是研發能力不足還是對國外藥品依賴日深之故?看來台灣廠商如果要進入大陸市場,以同文同種的優勢場與大陸廠商合作,應該是很不錯的選擇。
常見實務問題
最後,王美花也提出了生技醫藥專利申請之應考量因素及實務常見問題,她特別強調:專利說明書必須明確記載實施方式等。 因為可核准之申請專利範圍的大小,主要是看先前技術與說明書揭露內容而定,但生技醫藥發明通常很難由其產物本身的結構來推論如何製造及使用該產物,但是說明書通常必須記載一個或多個代表性實施方式或實施例,說明該產物如何被製造及如何被使用,(即據以實現要件) 。
當專利說明書被認為違反可據以實現要件時,申請人雖然可以提出申復、相關文獻、補充說明或實驗結果等資料,但卻不得於說明書中增加新的實施方式、實施例或實驗數據,因此王美花強調:說明書須明確記載實施方式,以免核准之申請專利範圍受到限縮。

|





