|
2018年09月10日,美国联邦巡回上诉法院(CAFC)于Regents of the University of California案[1]判决维持美国专利审理暨诉愿委员会(PTAB)审定,认定有关CRISPR/Cas9系统的使用方法发明在MIT- Harvard博德研究所(Broad Institute)拥有的美国第359号[2]等12个专利和美国第551号专利申请案[3],与加州大学(UC)所提出的美国第859号专利申请案[4]的申请专利范围间,因后申请的Broad Institute专利对UC申请案具有进步性,故两发明间「没有事实上冲突」(No Interference-in-Fact),双方可各自保有已被核准的专利权。
本案相关专利权均于2011年《Leahy-Smith美国发明法案》(美国AIA法案)在2013年3月16日生效前所申请,故适用美国AIA法案施行前的先发明主义(First to Invent)制度。专利权之专有排他性系专利制度中的一项重要原则,在美国先发明主义下,有发生不同申请案间包含了相同或实质相同的发明人争议时,美国专利商标局(USPTO)依据美国AIA法案前专利法第102条第g项[5]规定,仅能核发专利予其中一位专利申请人,并以冲突程序(Interference Proceedings)[6]厘清谁是真正具有专利申请权之第一发明人(First inventor)[7]。
系争专利范围:CRISPR/Cas9系统的使用环境差异
本案所牵涉的专利系有关使用CRISPR/Cas9系统于切断特定DNA序列的方法发明,系统均包含三个组件(element):(1)CRISPR RNA (crRNA)、(2)转录活化crRNA (trans-activating crRNA,tracrRNA) 和(3)Cas9蛋白。本技术藉由Cas9 蛋白结合以 crRNA 与 tracrRNA 形成的 pre-crRNA,复让RNase III 加工形成成熟的 crRNA,使得 Cas9/ tracrRNA:crRNA 复合体据以辨识与切割互补的 DNA序列目标(参考图1)。
图1. 由crRNA 和tracrRNA复合体引导的Cas9蛋白
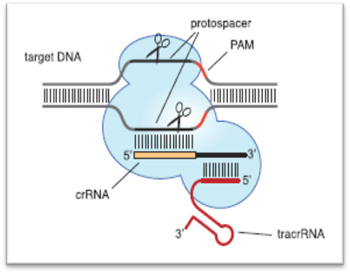
数据源:Patent Interference No. 106,048(DK), PTAB, Feb. 15, 2017 |
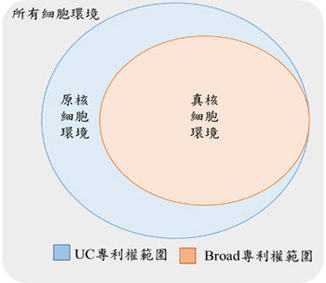
图2. 双方之CRISPR/Cas9专利范围
制表:李秉燊 |
为分析本案两发明是否为同一发明,PTAB和CAFC皆从双方专利请求项开始判断,表1为UC和Broad Institute各自代表专利请求项的申请专利范围对照。
由表1可得知,不论UC申请案的请求项,抑或Broad Institute专利的请求项均包含一引导蛋白,即crRNA、一与Cas9 蛋白结合的tracrRNA和一Cas9 蛋白;UC请求项并未限定于任何环境中实施该方法发明,Broad Institute请求项则明显限制在真核细胞内的环境中实施,则造成UC专利范围仅剩在原核细胞内具有专属的排他权利(参考图2)。

数据源:Regents of the University of California v. Broad Institute, Inc. at 3-5 (Fed. Cir. 2018);中文翻译:李秉燊
2017年PTAB审定双方专利权「没有事实上冲突」
PTAB以双向测试法(Two-Way Test)判定Broad Institute和UC各自所拥有的专利是不同的申请目标(distinct subject matter),并非法定重复专利,且认定Broad Institute的专利申请目标较UC的申请专利范围具有进步性,故Broad Institute和UC仍可各自拥有已获核发的专利。
所谓双向测试法,系指将双方专利申请案(包含系争案与引证案)相互比较,判断其中一发明是否被另一发明所先占(anticipate),或因此显而易知(render obvious)等新颖性和进步性专利要件[8];反之亦然,唯有两次的相互比较判断结论均为不具新颖性或进步性,双方专利才会被认定在可专利性上不可区别,成立重复专利,进而再继续判断谁应该是该重复专利的发明人,而撤销另一人已获核发的专利。
PTAB审定书指出,基于Broad Institute的举证已充分显示其将CRISPR/Cas9 系统皆限制于真核细胞(eukaryotic cells)环境中使用的专利请求项,与UC未限制于任何环境中使用的专利请求项有所不同,故具有新颖性;证据亦显示因为该发明所属技术领域中具有通常知识者(PHOSITA),未曾有过合理预期原使用在原核细胞(prokaryotic cells)环境中的CRISPR-Cas9系统技术,能成功地在真核细胞的环境中使用,故将该技术限制在真核细胞的环境中使用,较未限制该系统在任何环境中使用的发明具有非显而易见性(non-obviousness)。因此,本案中两发明间各自的申请专利范围非不可区别而未冲突,双方可各自维持已受核发的专利。UC不服PTAB审定对于本案系争专利进步性的判定,将本案上诉至CAFC。
2018年CAFC判决维持PTAB审定
CAFC对PTAB据以认定专利进步性的事实证据进行重新审理(de novo review),由于认同PTAB认定PHOSITA在UC申请专利后,仍不具有将CRISPR-Cas9系统应用在真核细胞的环境中会成功的合理预期,因此最后判决维持PTAB认定Broad Institute的申请专利范围相对UC的具有进步性的审定结果。
CAFC以PTAB审理时的事实证据重新审理双向测试法中审查UC专利申请案是否导致Broad Institute的专利申请标显而易知(render obvious),即是在审查发明专利的进步性要件。美国法院在审理进步性要件时,主要采Graham的四个因素依序判断,包含:(1) 相关先前技术所揭露内容、(2) PHOSITA技术水准、(3) 该发明与相关先前技术所揭露内容间差异,和(4) 客观事实审查,该客观事实包含PHOSITA是否有动机去结合或变更先前技术内容教示和是否有成功的合理预期(reasonable expectation of success)执行该结合或变更。
CAFC在此判决主要判断进步性要件中「成功的合理预期」,且一并审酌是否具有「具体教示」(Specific Instructions)和「同时间发明」(Simultaneous Invention)等辅助客观因素,最后认定Broad Institute的专利具有进步性。以下简述CAFC判决理由:
进步性要件中「成功的合理预期」判断
CAFC同意PTAB认定PHOSITA未曾有过合理预期原使用在原核细胞(prokaryotic cells)环境中的CRISPR-Cas9系统能成功地在真核细胞的环境中使用,故维持判决本案Broad Institute专利在发明当时不具有「成功的合理预期」,因此具有进步性。
本案在审理时,PTAB相当依赖双方专家证人证词、申请专利时期在期刊发表的文章,甚至是双方发明人在发明当时的公开陈述,作为理解所属技术领域在发明当时水平的证据;CAFC亦从这些事实证据中进行重新审查。
CAFC在判断本案Broad Institute专利在发明当时是否具有成功的合理预期时,首先采纳Broad Institute的专家证人证词指称 (1) 真核细胞的环境会改变Cas9蛋白折迭;(2)真核细胞内具有降解单股和双股RNA序列的核糖核酸脢(RNase),都将显著影响CRISPR/Cas9系统在真核细胞施用效果。例如真核细胞中的温度、各种离子组成比例、酸碱度和其他蛋白本即与原核细胞不同,遑论每种真核细胞间(例如植物细胞和哺乳类细胞)的上述组成也多所不同,这些都被认为会影响CRISPR/Cas9系统的运作功能;此外,在不同种类的真核细胞间,细胞内用于降解RNA序列的核糖核酸脢的数量与作用速率、机制也有不同,故在将CRISPR/Cas9系统运作于真核细胞时,许多试验条件都要实质调整[9]。
CAFC复采纳UC团队于2012年在期刊发表的科学文章,其认定UC所请的专家证人曾在该文章上承认未来将CRISPR/Cas9系统应用于真核细胞时,可能会发生CRISPR/Cas9被核糖核酸脢降解,且更因此造成真核细胞毒性;此外,文章亦提及真核细胞内DNA呈现致密缠绕成聚合体的染色质,CRISPR/Cas9系统恐无法应用在真核细胞内缠绕在一起DNA[10]。更有甚者,CAFC采纳Broad Institute提出UC团队的主要发明人Jennifer Doudna在申请专利后的演讲时曾公开宣称其团队并不确定CRISPR/Cas9系统是否可用于真核细胞,且未来将该系统应用在动物和植物细胞时将会是最大的瓶颈(huge bottleneck);复有证据显示UC团队在Broad Institute成功在真核细胞实施CRISPR/Cas9系统感到巨大震惊[11]。
综合上述专家证人证词、期刊科学文章和发明人的公开陈述,CAFC认同PTAB判定,即使本案发明当时的2012年,世人因UC团队发表的科学文章得知CRISPR-Cas9系统可用于原核细胞切割特定序列的DNA,基于前述已知真核与原核细胞内环境不同处,已有充分证据支持将原应用于原核细胞的相似系统技术另应用于真核细胞的环境具有高度不确定性和依赖实验条件的调整,因此在本案中PHOSITA并无法有将源自原核细胞的CRISPR/Cas9系统适用在真核细胞环境下会成功的合理期待[12]。
● 反向教示
UC于CAFC审理中抗辩PTAB在认定系争发明是否具有成功的合理预期时错误适用「具体教示」(specific instructions)的审查标准。其认为PHOSITA在发想具有creative step的发明时,并不一定参考前案(prior art)的具体教示,即使本案中没有前案的具体教示,亦不代表后续发明人就不会往该方向尝试,因此PTAB适用此标准时太过死板[13]。但CAFC驳回UC的抗辩,指出虽然本案中没有具体教示,但PTAB非因没有具体教示而认为系争发明没有成功的合理预期,而系考虑本案所具有的反向教示。CAFC于判决中指出PTAB在审查此标准时,不仅在审酌 (1) 是否有与CRISPR/Cas9系统相关的具体教示,亦在审酌 (2) 是否有在相似系统下成功或失败的前案例子,即反向教示(Teach away)。
CAFC认同PTAB的审查标准为:若有与系争发明相关的成功具体教示,将导致系争发明是成功的合理预期,但若为反向教示,应理解系争发明从前案得知了什么讯息,其表示本案中前案的诸多反向教示会使得Broad Institute在系争发明时缺乏成功的合理预期[14]。
● 同时间发明
UC于CAFC审理中亦抗辩PTAB并未审酌系争专利与引证案的发明时间相近,尤其本案系争发明期间,共有6组独立的团队同时将CRISPR/Cas9系统尝试应用于真核细胞,若没有成功的合理预期,不会有这么多组团队前仆后继的进行此项尝试;又在与系争发明申请日期的相近时间点,有多组团队成功将CRISPR/Cas9系统应用于真核细胞,代表此发明仅为PHOSITA的一般创作而非名副其实的发明,因此不具专利进步性[15]。
CAFC则指出同时间发明仅为认定进步性的其中一项审酌因素,应并入其他因素整体观之。CAFC亦说明同时间发明主要作为 (1) 所属技术领域通常知识的证据,和 (2) PHOSITA如何理解问题和拟定解决问题的方法,故亦仅为Graham的四个因素中理解「该发明与相关先前技术所揭露之内容间的差异」的一项指标。
以本案言,虽然在UC团队于2012年在期刊发表将CRISPR/Cas9系统应用于原核细胞的科学文章后,即有6组团队相继尝试将该系统应用于真核细胞,然而此仅能证明系争发明有动机结合前案,并不当然代表该发明有成功的合理预期;复进步性是将系争发明与引证案相互比较,以当时科学技术水准、已知的自然选择和前案的特别或共通性和所属领域的结果预期性,为整体观察系争发明是否相对引证案非显而易见,而非与当时其他与系争发明相近时间点的发明相比较[16],故仍维持PTAB在此议题的认定。
结语
生技领域中新兴技术的竞争日益激烈,撰写申请专利范围时不可不慎。以本案为例,UC团队虽早些申请大范围的CRISPR专利,却由于未明确划定范围,让Broad Institute以真核细胞环境为限制,被判定符合新颖性和进步性要件,取得并得保有系争专利。循此脉络,若后人可再成功将所属技术限缩于特定真核细胞(例如植物细胞和哺乳类细胞),甚至再进一步限缩至修改特定细胞(例如神经细胞)基因、治疗特定基因疾病(例如地中海型贫血症),均可以证明具有新颖性和进步性要件获得专利,为专利布局时应注意的议题。
于诉讼攻防上,由本案观之,CAFC主要依赖双方专家证人证词、申请当时期刊文章和发明人的公开陈述,作为理解所属技术领域在发明当时水平的证据,甚至据以判断是否具有反向教示。本案主要争点以「是否具有成功的合理预期」作为进步性的判断要件,故引证的发明前案是否具有反向教示便在判断上举足轻重。而同时间发明虽然认定系争发明有动机结合前案,但CAFC认为其不当然代表有成功的合理预期,故在作为生技领域专利诉讼的双方均应更进一步阐明系争专利与引证案间,为因应不同细胞、培养、操作下相异环境,如何造成实验成败或不同结果的详细实验设计考虑,以说服专利局和法院系争专利具有进步性。
备注:
- Regents of the University of California v. Broad Institute, Inc. (Fed. Cir. 2018).
- U.S. Patent No. 8,697,359
- Application No. 14/704,551.
- Application No. 13/842,859.
- Pre-AIA 35 U.S.C. § 102(g) (wherein “[a] person shall be entitled to a patent unless 14 . . . during the course of an interference . . . . another inventor involved therein 15 establishes . . . that before such person’s invention thereof the invention was made 16 by such other inventor. . . .”)
- MPEP, § 2301 Interference Proceedings, Ren. 08.2017
- 张宇凯,先申请主义、先发明主义、以及发明人先申请主义,北美智权报,第125期(2015年01月)http://www.naipo.com/Portals/1/web_tw/Knowledge_Center/Laws/US-105.htm
- 37 C.F.R. § 41.203(a). (“(a) Interfering subject matter. An interference exists if the subject matter of a claim of one party would, if prior art, have anticipated or rendered obvious the subject matter of a claim of the opposing party and vice versa.”)
- Supra note 1, at 8.
- Supra note 1, at 9.
- Supra note 1, at 9-10.
- Supra note 1, at 11.
- Supra note 1, at 12.
- Supra note 1, at 13.
- Supra note 1, at 14.
- Supra note 1, at 15.
 |
|
| 作者: |
李秉燊 |
| 现任: |
美国杜克大学法学院访问学者 |
| 学历: |
(台湾) 交通大学科技法律研究所博士生
(台湾) 交通大学科技法律研究所硕士生(径升博士班)
(台湾) 阳明大学医事技术暨检验学系硕士 |
| 专业资格: |
2018年度台湾专利师考试及格
2014年度台湾医事检验师考试及格 |
|
|
|

