癌症属于一种非传染性疾病,因此无法藉由人体免疫系统根除。虽然,外科手术,放射线和化学疗法等标准疗法持续进步,但癌症患者的总体生存率并没有明显提高。20世纪,癌症已经是人类十大死亡原因之一,每年剥夺许多生命,因此,各国生物科技政策与医药科技公司,莫不以癌症预防、检测与治疗作为首要发展。其中,CAR-T细胞治疗的发展特别受到关注,引发了许多大药厂间的商业并购与专利战争。
人类T细胞的扫描电子显微镜图
来源:https://www.flickr.com/photos/niaid/
以人类免疫系统预防疾病,特别针对应用于感染性疾病之预防,是一门被高度关注之研究领域。治疗性免疫系统的发展,可追溯至1798年,当时Edward Jenner申请「基本疫苗接种技术」以治疗天花(smallpox)。而到了18世纪后期,免疫疗法也适用到癌症治疗,William B. Coley博士认识免疫系统治疗癌症方法的力量,将其运用于为未愈合的溃疡肉瘤之手术切除。[1]
1980年末,Zelig Eshhar博士团队提出用生物技术将T细胞改造,而将T细胞重新定向至选定的标靶抗原[2]。随后,经过20多年漫长的研究,Dr. Rosenberg和他的团队,成功地将免疫疗法Chimeric Antigen Receptor(CAR)设计用于改造自体T细胞,并提出治疗黑色素瘤患者的新概念,而成功让70%的黑色素瘤肿瘤变小或消退。自此,CAR-T免疫疗法逐步进入人体试验阶段。
2017年8月30日美国FDA核准首例基因治疗产品Kymriah的上市申请。自此,全球有关CAR-T细胞治疗专利申请急速上升,而有关核准之治疗产品也随之增加。统计2017-2021年欧美日加各国卫生主管机关核准上市之CAR-T细胞治疗产品整理如表1。
表1:已核准之CAR-T cell therapy整理
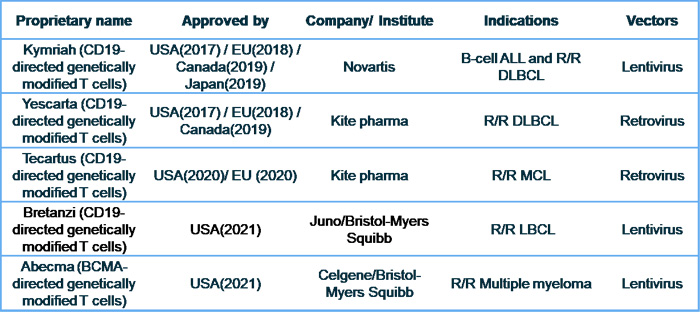
数据源:财团法人医药品查验中心,2021年4月
有关CAR-T细胞治疗技术,有许多研究显示,大多数肿瘤表达的抗原可以被T细胞受体识别[3],因此不只在黑色素瘤治疗具有功效,T细胞免疫疗法是否具有治愈恶性癌症的潜力,也成为科学家们关注的焦点。美国FDA核准之首例基因治疗产品Kymriah,为基因修饰的自体T细胞免疫治疗药物(genetically-modified autologous T-cell immunotherapy),其主要使用病患自身T细胞经过基因修饰后,用于治疗儿童及青少年之急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)。Kymriah上市前,在临床试验中已显示其对于疾病的缓解以及整体存活均皆有显著效果,包括:多组临床实验共计63名急性淋巴癌病患,经由Kymriah治疗的三个月内的整体缓解率为83%。
CAR-T细胞治疗与再生医疗试剂之核准
CAR-T技术属于细胞治疗产品,为国际新兴治疗产品,由法规管制分类来看,属于再生医疗制剂一种,其核准要件因各国对于再生医疗试剂法规制度差异,而有不同标准。以日本为例,系依日本药机法「有条件期限许可(conditional and time-limited approval)」予以核准。而美国则以「二十一世纪医疗法」、「再生医学先进疗法(Regenerative Medicine Advanced Therapy, RMAT)」等规定,以符合「严重疾病且初步临床证据显示可满足医疗迫切需求者」之要件,以提供加速核准机制。我国台湾地区卫生福利部食品药物管理署(TFDA)及财团法人医药品查验中心(CDE)自2013年起,陆续公布人类细胞治疗产品、基因治疗产品临床试验及查验登记审查基准与指导原则,相关审查规范整理如表2。
表2. 台湾地区人类细胞治疗产品、基因治疗产品临床试验及查验登记审查规范
审查基准(TFDA) |
2020年 |
人类基因治疗制剂临床试验审查基准(草案) |
2020年 |
人类细胞治疗制剂临床试验申请作业及审查基准 |
2015年 |
人类细胞治疗产品查验登记审查基准 |
指导原则/文章(CDE) |
2020年 |
基因治疗产品非临床毒理研发策略指导原则 |
2020年 |
基因治疗产品临床研发策略指导原则 |
2020年 |
基因修饰细胞产品的开发与制造管控相关法规 |
2018年 |
病毒载体之基因治疗产品于化学制造管制研发策略指导原则 |
数据源:https://www.cde.org.tw/knowledge/?pid=13&p=4\;https://www.cde.org.tw/Content/epaper/202017151052.html
TFDA为病人即早接受新兴医疗权益,并确保再生医疗制剂之质量、安全及有效,参考国际法规管理架构与趋势,采用严谨的「上市前审查、上市后监控」机制,自2017年积极推动台湾地区「再生医疗制剂管理条例(草案)」立法。台湾地区卫生福利部2021年2月9日公告修正「特定医疗技术检查检验医疗仪器施行或使用管理办法」(特管法),新增特定实验室定义,将接受医疗机构委托施行实验室开发检测之实验室纳入管理,而美国FDA亦要求使用Kymriah基因疗法的医疗院所,需经过特殊认证、医师以及管理人员都需要通过特别的培训课程,这与我国将质量管理规范纳入建置再生医疗制剂与细胞治疗医疗技术考虑不谋而合,显示不论是医疗技术或产品研发,保障民众治疗与用药之安全、质量与疗效,实为各国主管机关首要重点。
全球CAR-T细胞治疗相关专利申请急速成长
2017年美国FDA核准二个CAR-T细胞治疗,分别是Gilead(吉利德公司)的Yescarta和Novartis(诺华公司)的Kymriah。二者由于治疗效果佳,短短上市二年期间,Yescarta预估2021年全球市场将突破10亿美元收益,而Kymriah也将几年内达到10亿美元的收益[4]。
市场上并大胆预估,到2026年,全球CAR-T疗法市场预计将超过135亿美元。庞大的市场商机,致使CAR-T细胞研究的爆炸式增长。2019年末,据统计全球有800多种不同的CAR-T临床试验,美国共有683项CAR-T专利申请案被公开(其中包括124项公告专利),欧洲专利与PCT专利申请案亦有成长的趋势[5]。在市场庞大利益带动下,使CAR-T技术专利权人,利用各个专利行政程序与专利诉讼策略,以取得市场的优势地位。
美国CAR-T细胞治疗相关专利争议
2020年,加州联邦地方法院判决Gilead的Yescarta故意侵害Juno Therapeutics(Juno公司)的专利,而须赔偿11亿美元,确认CAR-T核心技术专利的价值[6]。而Kymriah上市前,Novartis也因CAR-T技术专利争议,于2015年以1225万美金与Juno公司和解。以下摘要此二件专利争议:
1. Juno与Novartis:于2015年以1225万美金和解
Kymriah为美国核准的第一个CAR-T治疗技术。然而核准上市之前,Kymriah的拥有者:Novartis早在2015年与Juno公司就CAR-T治疗专利发生过争议,最终双方和解。
2015年Juno Therapeutics,Inc.在一项依照美国证券交易法所要求FORM 8/K[7]申报中,揭露2013年其与宾夕法尼亚大学(UPenn)和Novartis,因侵害Juno公司嵌合抗原受体(CAR)治疗的专利,即U.S. Patent No. 8,399,645(简称645专利)[8]之诉讼,签署和解协议之讯息。该项公司重大讯息指出,645专利原为St. Jude医院所有,由于Juno公司自St. Jude医院取得645专利之全球专属授权契约,因而取得全球专属开发、制造、商业化之所有治疗性、诊断性、预防性、产品与安灵缓和治疗之使用(palliative uses)。根据诉讼和解契约,Novartis同意向Juno公司支付费用,以取得未来非专属实施645专利之权利。Novartis所同意支付之费用,包括一次性支付1,225万美元的前金、依照开发进度所设定里程碑支付权利金,以及后续支付产品销售权利金。[9]
2. Juno与Glide:专利争议尚在上诉中
Yescarta(又名Axi-cel或axicabtagene ciloleucel)是美国第二个核准上市的CAR-T疗法,用于成人复发或难治性大B细胞淋巴瘤治疗方法,一个疗程的药物费用为$ 373,000美元。[10]Yescarta系Kite Pharma公司所研发CAR-T疗法,由于2017年10月由Gilead公司以119亿美元代价收购Kite公司,同年10月Yescarta核准上市。
Yescarta的核心技术最初是由美国国家癌症研究所(NCI)的外科分院所开发的技术,该项技术后来专属授权给Kite Pharma进行进一步开发完成[11]。2017年10月18日,Juno公司以及Memorial Sloan Kettering 癌症中心、Sloan Kettering Institute for Cancer Research共同控告Kite Pharma其销售的嵌合抗原受体T细胞(CAR-T)治疗,恶意侵犯Juno公司的美国7,446,190专利之第1、第3、第5、第9和第11请求项。[12]Kite Pharma制药公司随后主张不侵权,以及抗辩专利无效,二项主张均被法院驳回。
2019年,陪审团判定专利侵权,并裁定本案专利侵权的赔偿额为7.52亿美元,2020年加州中区联邦地方法院因为恶意侵权,提到损害赔偿金额至11.8亿美元[13]。除此之外,判决要求Kite应自2019年12月开始支付专利权利金至2024年,其权利金为Yescarta销售净收入的27.6%[14],可预期Yescarta的收益会因为损害赔偿而大幅减低。
本件争议的专利,为必治妥施贵宝(Bristol Myers Squibb,BMS)子公司所有的liso-cel(lisocabtagene maraleucel)CAR-T疗法,该疗法是BMS从Celgene收购中获得。2018年,Celgene以现金90亿美元收购Juno,因而取得Juno名下的专利权与专利授权之主导权。2019年Celgene被BMS以740亿美元代价收购为子公司,而使得BMS取得Juno所拥有CAR-T技术。而本案专利为US 7,446,190(简称190号专利),涉及使用嵌合T细胞受体促进T细胞对特定靶标反应的方法,系由Memorial Sloan Kettering癌症中心开发技术,2013年11月21日由Juno自Sloan-Kettering癌症研究取得该项技术之专属授权。
190专利请求项第一项记载,编码嵌合T细胞受体的核酸聚合物,所述嵌合T细胞受体包括(a)包含人CD3ζ链胞内结构域的zeta链部分,(b)共刺激信号区域,和(c)与选择的靶特异性相互作用的结合组件,其中所述共刺激信号传导区域包含由SEQ ID NO: 6编码的氨基酸序列。本项记载揭露一种编码具有三个特定组件的CAR-T细胞:(1)针对靶标(例如CD19)的抗原结合分子;(2)共刺激的CD28结构域;(3)CD3ζ的胞内结构域。其作用机制为CAR-T细胞与靶标结合,CD3ζ组件就会发送信号杀死目标癌细胞。而添加共刺激信号(例如CD28)可以改善T细胞活化以及CAR-T治疗的持久性和有效性。
在Juno公司控告Kite公司之前,Kite公司曾于2015年8月向美国专利局提出190号专利多项请求项欠缺显著性而无效之第三复审程序(Inter Partes Review,简称IPR)[15],2016年12月16日美国专利初审及上诉委员会(PTAB)做出书面决定,认定190专利有效[16]。由于Kite公司于诉讼前曾提出IPR程序,以及合作开发的研究人员曾经接触Sloan Kettering癌症中心的研究团队,因此陪审团认定侵权之故意。2020年5日Kite公司针对全案提出上诉。[17]
小结
我国台湾地区TFDA于2018年正式成为国际医药法规协和会(ICH)药政法规单位会员,参与制定国际药品法规指引,期待未来我国台湾地区能尽速完成再生医疗相关法规之立法工作,引领产业接轨国际,共同创造良好的法规环境,并提供民众安全有效、质量优良的药品,特别是CAR-T细胞治疗除了有机会为若干癌症病患带来一线转机外,其庞大的市场引发市场以百亿美金代价,并购握有主要技术来源的公司,以累积相关技术专利,以提高竞争力。在产品上市前后,竞争对手间也运用许多专利诉讼策略,以强化本争竞争力,快速占有市场,包括提出第三人复审与专利侵权主张,许多做法在可以2010年前后的全球3G手机专利战看见类似策略。未来国内厂商投入相关细胞治疗产业,应以为借镜。
备注:
- Postgrad Med J. 2003 Dec; 79(938): 672–680.).
- Transplant Proc. 1989 Feb;21(1 Pt 1):127-30.
- Immunol Rev . 2009 May;229(1):126-44.
- Patent issues in CAR-T technology , https://www.iam-media.com/litigation/patent-issues-in-car-t-technology
- 同上。
- Juno Therapeutics, Inc. et al v. Kite Pharma, Inc., No. 2:2017cv07639 - Document 728(C.D. Cal. 2020)
- 发行人发生重大事件时,须申报Form 8-K。美国证管会认为符合重要信息原则之事项计有:公司之收益、合并、收购企业、股权收购、创业投资、取得或处分重大资产、新产品或发明、开发客户或供货商(如取得或失去合约)、控制权或管理阶层变动、更换签证会计师、与发行公司证券有关事宜及破产及代管等信息。
- U.S. Patent No. 8,399,645,专利名称为「具有4-1BB刺激讯息领域的嵌合受体」(Chimeric receptors with 4-1BB stimulatory signaling domain),https://patents.google.com/patent/US8399645B2/en。
-
https://www.sec.gov/Archives/edgar/data/1594864/000119312515119464/d903616d8k.htm
- 定价37.3万美元 第二款CAR-T细胞药物Yescarta获批,https://med.sina.com/article_detail_100_2_35161.html
- Kite Pharma, https://en.wikipedia.org/wiki/Kite_Pharma
- Case NO: 2:17-cv-07639, https://storage.courtlistener.com/recap/gov.uscourts.cacd.691790/gov.uscourts.cacd.691790.1.0.pdf
- 除了陪审团所判赔的7.52亿美金,另包括因为恶意侵权而追加3.89亿美金之损害赔偿。Juno Therapeutics, Inc. et al v. Kite Pharma, Inc., No. 2:2017cv07639 - Document 728 (C.D. Cal. 2020),https://law.justia.com/cases/federal/district-courts/california/cacdce/2:2017cv07639/691790/728/
- 同上
- 有关第三方复审程序的观念请参考,https://iknow.stpi.narl.org.tw/Post/Read.aspx?PostID=10274。
- https://s3-us-west-1.amazonaws.com/ptab-filings%2FIPR2015-01719%2F72
- 2020-1758 - Juno Therapeutics et al. v. Kite Pharma, Inc. https://portal.unifiedpatents.com/litigation/Court%20of%20Appeals%20for%20the%20Federal%20Circuit/case/2020-1758
好消息~北美智权报有微信公众号了!
《北美智权报》内容涵盖世界各国的知识产权新闻、重要的侵权诉讼案例分析、法规解析,以及产业与技术新知等等。
立即关注北美智权微信公众号→ NAIP_IPServices
~欢迎读者分享与转发~ |
 |
|
【本文只反映专家作者意见,不代表本报立场。】
| 作者: |
叶云卿 |
| 现任: |
北美智权(cn.naipo.com)外稿作家
台湾世新大学 知识产权研究所 副教授
台湾科技大学 专利所 兼任助理教授 |
| 学历: |
美国旧金山金门大学 法律博士(SJD)
美国华盛顿大学 法律硕士(LLM)
台湾政治大学 法律硕士
台湾大学环境工程所 工程硕士 |
| 经历: |
台湾科技大学专利所 助理教授
美国旧金山 Suzan See Law Office法务
美国硅谷 Vivian Lu Law Office法务
台湾建业律师联合事务所律师
台湾环宇律师事务所律师 |
| 产学合作计划: |
美国诉讼管理产学合作计划 |
| 代表著作: |
营业秘密刑事责任
中小企业知识产权管理制度建置
专利意见书在诉讼上之运用 |
| 證照: |
律师、台湾专利代理人、环境工程技师、仲裁人、ISO14000管理师 |
|
|
| 作者: |
张连成 |
| 现任: |
台湾阳明交通大学药物科学院药学系 兼任助理教授 |
| 学历: |
台湾阳明大学生物药学所博士 |
| 经历: |
TFDA 技正、副研究员、科长 |
|
|
|

